普洛麦格(北京)生物技术有限公司品牌商
16 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
热门应用 | 免疫原性细胞死亡ICD:检测损伤DAMPs 的新方法
72 人阅读发布时间:2025-11-14 14:11
在过去的50年里科学家们对于细胞死亡的研究发生了许多有趣的转变。至今为止,人们普遍认为细胞的死亡机制对所有生物体具有重大影响。因此在近几年内,免疫原性细胞死亡(Immunogenic Cell Death,ICD)因其对先天性和适应性免疫反应的影响而备受关注。
本文导读:
-
什么是免疫原性死亡ICD
-
什么是损伤相关分子模式DAMPs
-
检测免疫原性细胞死亡的常规方法
-
检测细胞外ATP和HMGB1的改进方法
-
炎性检测主要工具及资源
免疫原性细胞死亡
多细胞稳态由一系列经过精心安排的程序性细胞死亡机制所维持。这些程序通常分为“耐受原”或“免疫原”模式。耐受原形式(也称为免疫沉默细胞凋亡)涉及成熟的内在或外在信号级联反应,可激活 Caspase 及重塑细胞膜脂质的不对称性。磷脂酰丝氨酸从细胞膜内侧外翻至细胞膜外侧的过程对于细胞凋亡具有关键作用,该过程提供了必要的“吃我”信号,从而促使吞噬细胞在膜完整性丧失之前吞噬濒死细胞。
免疫原性细胞死亡(Immunogenic Cell Death,ICD) 这种细胞死亡形式不会促进炎症反应,并且通常与在细胞发育和组织重塑过程中有效去除老化、受损、多余或不必要的免疫细胞或其它类型细胞有关。
损伤相关分子模式
损伤相关分子模式(Damage associated molecular patterns,DAMPs)是在ICD期间产生的特定生物分子信使,它介导了该过程的进展速度及发展程度。因此对DAMPs进行主动调节会对健康和疾病产生重要影响。
炎症反应模式,或称为免疫原性细胞死亡,可以进一步分为多种子程序,例如坏死性凋亡、细胞焦亡、铁死亡、NETosis或其它独特形式的细胞凋亡。无论特定的子程序如何,DAMPs都将暴露和/或释放到细胞外环境中,从而使免疫细胞浸润及随后的局部炎症反应持续存在。ICD是抵御病毒和细菌攻击以及肿瘤特异性细胞毒性T细胞发育成熟的第一道重要防线。ICD 也可被破坏,因此产生各种急慢性病症。
胞外ATP (Extracellular adenosine triphosphate,eATP) 和 高迁移率族蛋白B1(high mobility group box B1,HMGB1)是两种对建立免疫原性细胞死亡表型非常重要的DAMPs。虽然细胞外ATP主要作为通用能量传输分子,但其也参与多种细胞间的信号传递。eATP作用通过在多种细胞类型上表达的P2嘌呤受体介导信号进行传递。在ICD情况下,来自濒死细胞的eATP为树突细胞(抗原处理细胞)提供初始趋化梯度,然后通过响应免疫细胞的旁分泌维持炎症环境。
胞外ATP(eATP)
细胞外ATP主要作为通用能量传输分子,但其也参与多种细胞间的信号传递。eATP作用通过在多种细胞类型上表达的P2嘌呤受体介导信号进行传递。在ICD情况下,来自濒死细胞的eATP为树突细胞(抗原处理细胞)提供初始趋化梯度,然后通过响应免疫细胞的旁分泌维持炎症环境。
高迁移率族蛋白B1(HMGB1)
HMGB1是一种主要与核染色质相关的、非组蛋白的蛋白质,它被分隔在细胞核中。在ICD期间HMGB1转移到细胞质,最终通过目前尚不明确的通道激活事件或通过细胞死亡后膜完整性丧失而被动释放到细胞外环境中。细胞外HMGB1以各种氧化还原状态存在,可促进树突细胞成熟及炎症的整体恶化。
尽管每个生物标志物均可单独预测评估免疫原性细胞死亡程度,但eATP及HMGB1组合的缺失或存在可提供比单一检测参数更具效力的表型统计指标。因此,可快速简便地对这两种生物标志物进行检测是发现和开发ICD调节相关研发活动的关键因素。
检测免疫原性细胞死亡的常规方法
在ICD期间,eATP和HMGB1以时间依赖型的方式释放到细胞外环境中。目前所用检测方法为通过去除一定体积的培养基并将其低速离心以去除细胞和/或细胞碎片,在一段时间内定期收集和处理细胞上清液样品。在检测特定分析物的水平之前,通常将上清液置于+4或-20°C下。若不能做到重复收集和处理上清液、去除细胞或碎片或适当地储存它们,这会使eATP及HMGB1的量化变得复杂。
终点法进行量化
通过这种方法,使用含有过量萤光素酶和萤光素的反应混合物与含有未知含量eATP的样品进行接触。生物发光反应将产生与样品中的eATP含量成正比的光子。但是从上清液中准确地进行eATP检测尤其困难。例如大多数转化细胞系具有增强的细胞膜 ATP 酶的表达(如CD39),并可在血清中传播和维持,因此血清也含有显着的ATP酶活性。这些胞外吡喃酶反应通过在几分钟内显著降低eATP水平,使实验释放的eATP浓度在采样和处理过程中处于极不稳定状态(图1)。
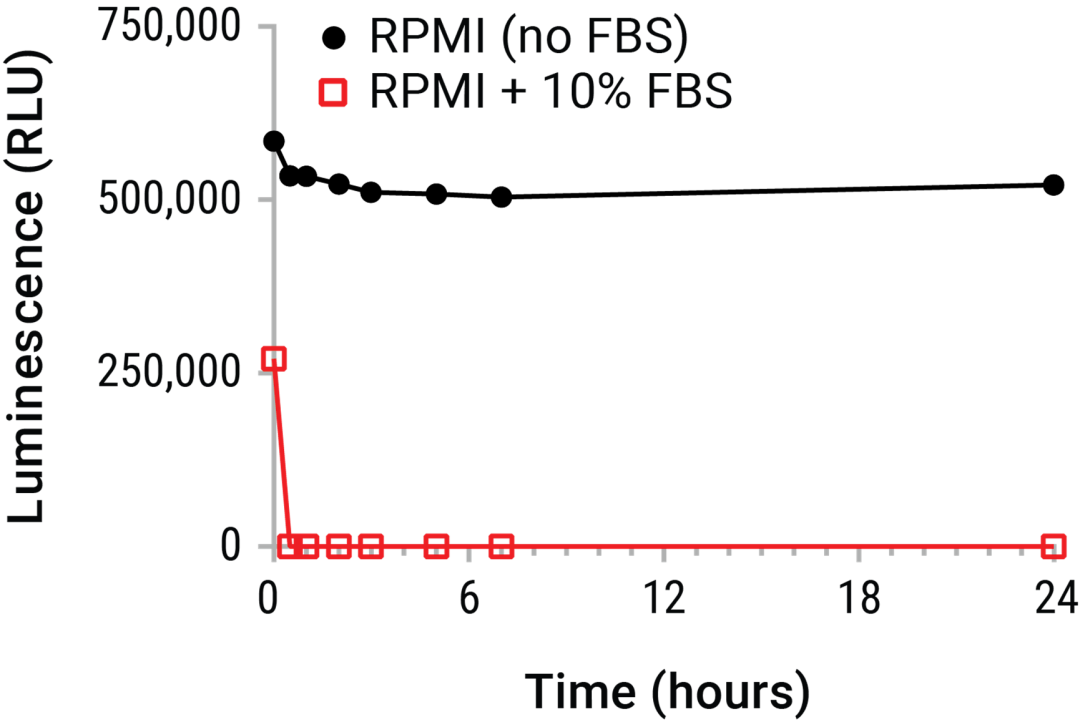
图1. 在细胞培养环境中的细胞外ATP状态不稳定。将纯化的ATP(20nM)加入含或不含10% FBS的RPMI 1640中并置于冰上。定期取出样品并在37°C下培养24小时。使用CellTiter-Glo® Luminescent Cell Viability Assay在培养结束时检测所有样品的ATP含量。实验数据明确指出标准的上清液收集方法在短时间内会面临大量eATP衰减的风险。检测开始前的这种衰减可能大大低估eATP含量。因此明确了需进行衰变前eATP的实时检测。
Western Blot 或 ELISA
虽然 Western 可提供分析物释放的关键生化证据,但其定量性较差、操作繁琐。同样ELISA检测法也很耗时耗力,但其灵敏度尚可。并且ELISA检测法也存在动态范围差的问题。这种有限的动态范围需要在检测前稀释样品,使其结果落在检测的线性范围内。当样品的分析物含量未知时,样品必须以各种稀释水平进行检测,从而增加了需处理的样品数量。此外,至少有一个经过良好验证的商业供应商的检测可能成本高昂。
检测细胞外ATP和HMGB1的改进方法
量化检测DAMPs的传统方法可提供实用信息,但这些实验方法的操作可能费时费力。我们已成功开发两种无需样品收集和处理的新型均质化化学成分检测试剂盒,极大地简化了ICD的分析工作流程。您可以简单地配制相应的试剂并将它们加入到平行的实验样品培养孔中。
RealTime-Glo™ Extracellular ATP Assay包含热稳定性的 Ultra-Glo®萤光素酶及化学纯的萤光素,并且它们的配方可与活细胞兼容(图2)。这些成分可与生长培养基混合,并在“零”时间点添加到处理和未处理的细胞中,以检测eATP的释放量随时间的变化(图3)。检测试剂盒中反应物的实时耐受性已经过细致地优化,因此不会干扰未处理细胞的固有生物学特性,并且可以建立eATP释放的基线。
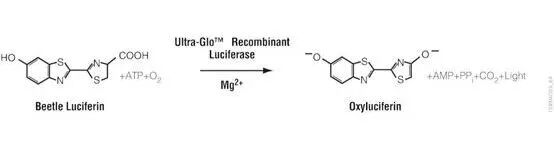
图2. 细胞外ATP生物发光化学反应。
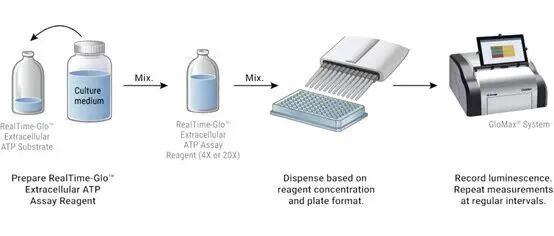
图3. RealTime-Glo™ Extracellular ATP Assay 的工作流程。
新型检测试剂盒除可节省研究人员的大量时间和精力外,其实时读数的功能还可提供整个实验过程中eATP含量的实时连续报告。当在动力学模式下使用可加热的发光检测仪并以自动化程序控制时,并且使用具有气体控制单元或使用CO2非依赖性培养基,该检测试剂盒在最终暴露时间点可做到真正的“不干涉”(图4)。
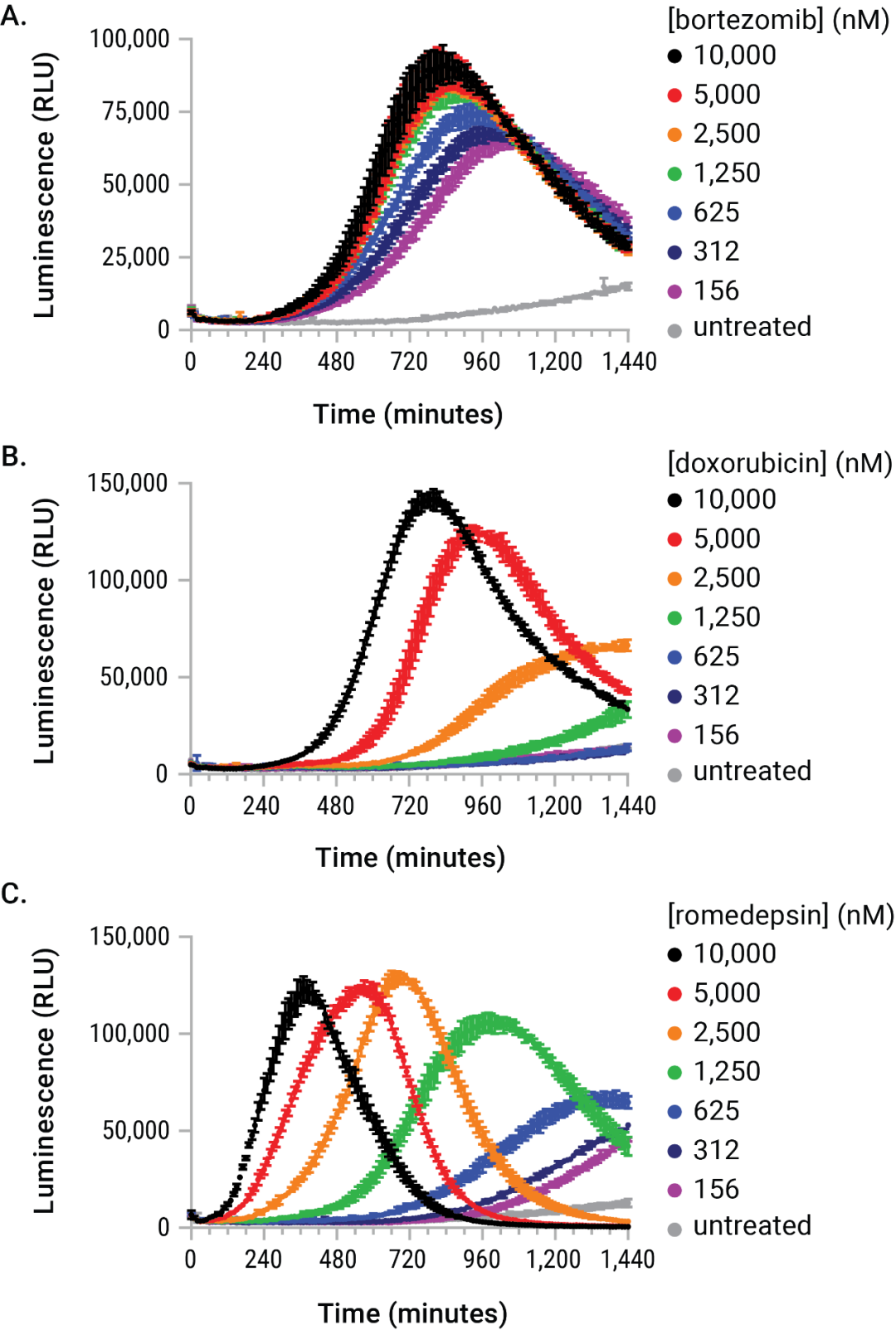
图4. eATP受刺激驱动的释放含量随剂量和时间变化。在使用 RealTime-Glo™ Extracellular ATP Assay 试剂的情况下,将U937细胞用硼替佐米、阿霉素和罗米地辛的系列稀释液进行处理。药物处理期间所产生的eATP释放曲线在剂量、时间和信号强度等方面在动力学上是强大的。这些差异会使任意终点的eATP含量难以解释并且可能造成实验结果不准确。
Lumit® HMGB1 Immunoassay 试剂可以在药物处理完成时直接添加到检测孔中。该试剂包含萤光素酶底物和两种抗HMGB1单克隆抗体,它们已与经过合理分割和优化后的萤光素酶的互补元件(LgBiT 或 SmBiT)结合(图5)。在没有HMGB1分析物的情况下,抗体偶联物在溶液中保持游离且未结合状态,仅产生轻微的发光信号。在HMGB1存在的情况下,抗体与其同源的抗原表位结合并促进 LgBiT 和 SmBiT 在抗原上的诱导近距离互补作用。这种情况可使发光信号与分析物的量成正比。因此化合物的ICD诱导特性可以通过以下反应的效力和幅度与时间的关系来描述(图6)。
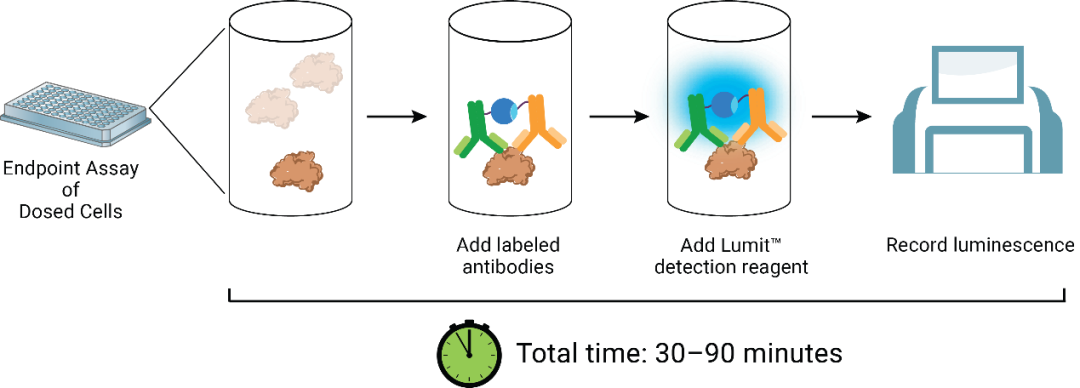
图5. Lumit® HMGB1 Immunoassay 的概念和工作流程。
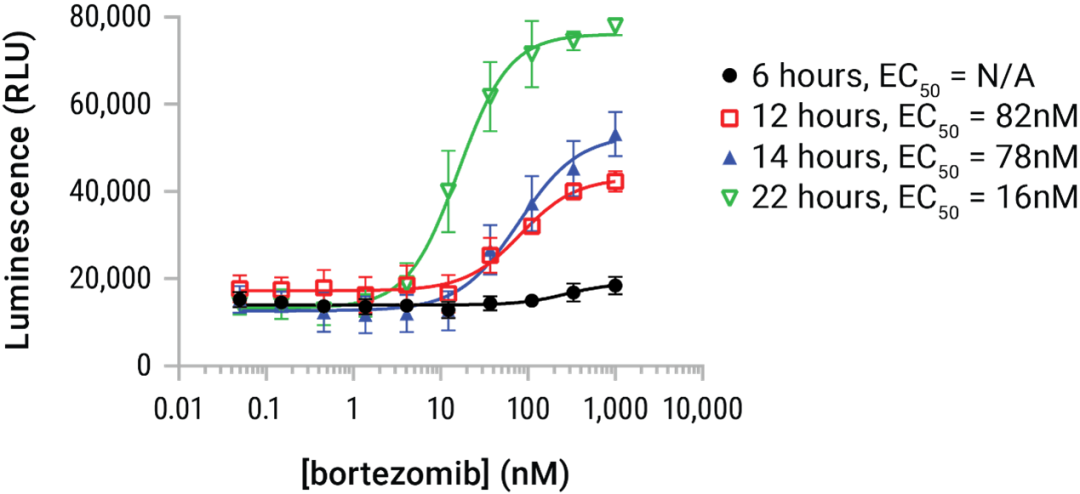
图6. HMGB1的释放为剂量和时间依赖型。在实验化合物孵育 6、12、14 和 22 小时的时程中,将U937细胞用硼替佐米的系列稀释液进行处理。在终点添加 Lumit® HMGB1 Immunoassay 试剂并收集发光信号数据。硼替佐米开始持续释放HMGB1约 6 小时,并可在整个 22 小时的时程中继续影响额外的HMGB1释放量。在该模型中HMGB1 的释放量随时间增加,但HMGB1在长期暴露中容易丧失抗原性。因此 24 和 48 小时的处理时长通常适用于未知潜力或效力的化合物。
值得注意的是,可以使用Lumit® 方法对未处理的细胞样品或由其所取上清液进行ICD诱导释放后的HMGB1抗原进行检测。这两种样品类型都与现有的ELISA检测法具有良好相关性(图7)。此外来自实验的诱导和未诱导值可以与试剂盒中提供的重组人HMGB1的标准曲线进行比较。已有其它实验证明该试剂盒与小鼠同种型HMGB1具有显著的交叉反应性,可以在类似的诱导系统中进行分析。
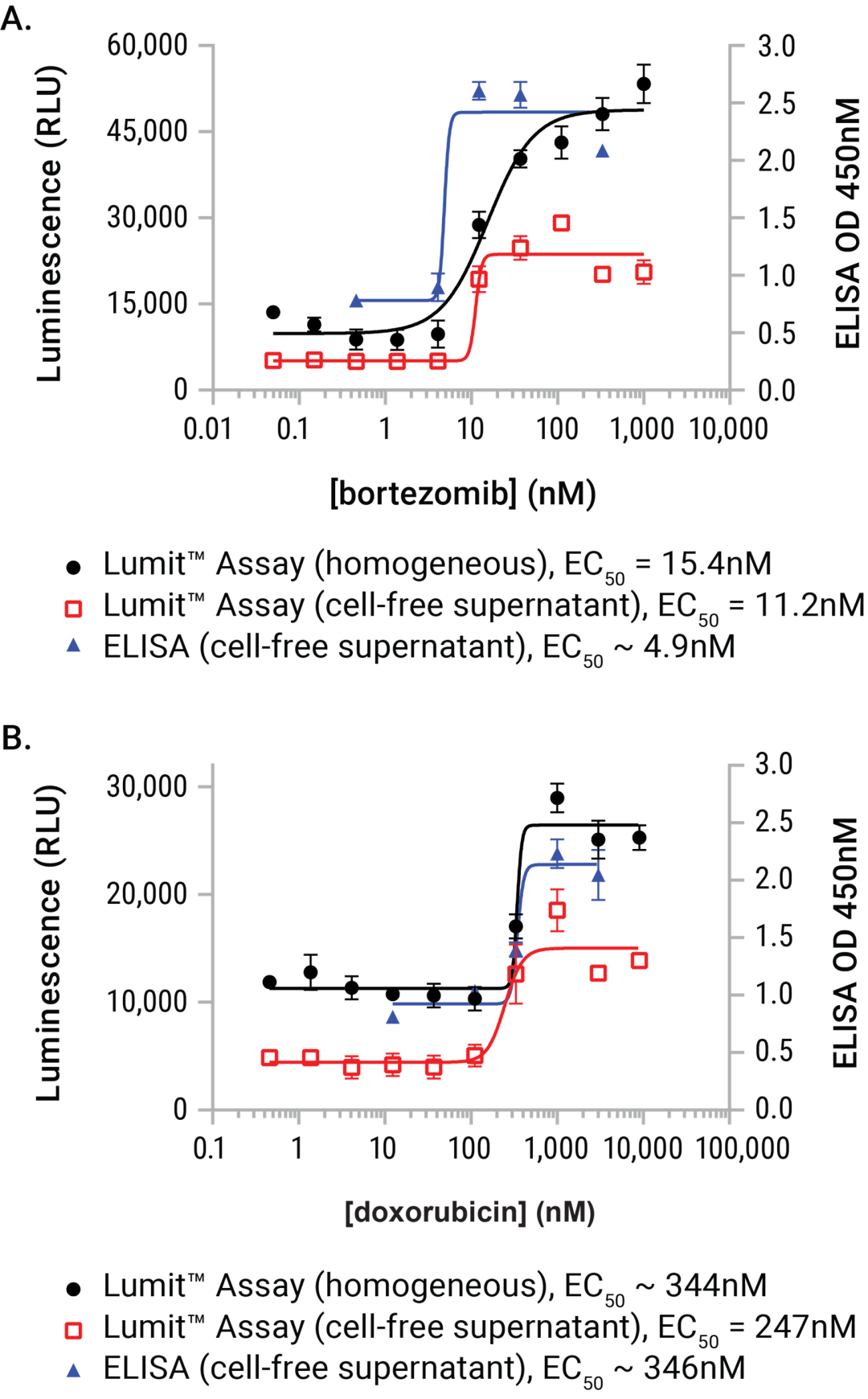
图7. Lumit® HMGB1 Immunoassay 与商品化ELISA试剂之间的性能比较。将U937细胞用硼替佐米或阿霉素稀释处理24小时。暴露完成后,从检测板的平行孔中制备无细胞上清液。将 Lumit® HMGB1 Immunoassay 试剂加入含有已处理细胞的孔中或收集的上清液中。并且使用商品化 HMGB1 ELISA 试剂检测上清液(及上清液的稀释液)。这两种实验样品与商品化ELISA检测法表现出高度的一致性,并且收集结果所需的时间显著减少(使用 Lumit® HMGB1 Immunoassay 需要 1.5 小时,而使用 商品化ELISA试剂需要 25.5 小时)。
小结
两种新型的均质免疫原性细胞死亡检测试剂盒具备“添加-混合-检测”的新特性,可显著提高通量并可减少检测和表征新ICD诱导化合物的工作量。新型检测试剂盒的效率提升是通过避免不必要的样品收集和处理步骤,以及通过消除与检测相关的孵育和洗涤步骤来实现的。
炎性检测主要工具及资源