普洛麦格(北京)生物技术有限公司品牌商
16 年
手机商铺
- NaN
- 0
- 1
- 0
- 3
推荐产品
公司新闻/正文
使用均相生物发光检测法监测cGAMP的生成与降解
32 人阅读发布时间:2025-11-27 13:44
使用均相生物发光检测法监测cGAMP的生成与降解
干扰素基因刺激因子(STING)是一种位于内质网的跨膜蛋白,作为分子枢纽响应胞浆环状二核苷酸(CDN)第二信使,如环GMP-AMP(cGAMP)。当细胞外微生物DNA及细胞内(细胞核和线粒体)DNA通过环磷酸鸟苷-腺苷酸合成酶(cGAS)途径产生cGAMP后,cGAMP会直接与STING蛋白结合进而激活STING信号通路。该胞浆DNA激活作用启动级联反应——cGAS-STING-TBK1-IRF3信号传导,诱导I型干扰素反应,最终通过通路组分降解和刺激DNA清除终止信号。
鉴于STING通路作为DNA传感器对病原体的关键适配器作用,并参与免疫感应、肿瘤生长控制及自身炎症与自身免疫疾病调控,该通路已成为重要药物靶点。可靠证据表明cGAS–cGAMP–STING通路对至少三大癌症疗法(放射治疗、化学治疗与免疫治疗)具有基础性贡献,因而成为前景广阔的靶点。当前需筛选有效调控人源STING的先导化合物以推进药物研发。
为此,我们开发了监测胞内外cGAMP浓度的生物发光检测法。
Lumit® cGAMP技术优势:
-
操作简便,一小时内即可完成。属于均相检测且无放射性。
-
适用于96孔板和384孔板规格。
-
基于生物发光原理,因此不受荧光化合物干扰。
-
灵敏度高,可检测纳摩尔级低浓度cGAMP。
-
可用于cGAS酶活性的动力学研究。
-
可检测低浓度的细胞内cGAMP。
-
检测信号可稳定维持长达3小时,信号衰减率仅为25%。
技术原理
Lumit® cGAMP免疫检测基于NanoLuc®萤光素酶互补技术的新型蛋白质互补分析(PCA)原理:通过连接子与cGAMP偶联的NanoLuc®衍生小肽(SmBiT)可作为cGAMP示踪剂,与抗cGAMP的一抗结合,被连接NanoLuc®互补片段(LgBiT)的对应二抗识别,添加NanoLuc®底物后产生生物发光。反应中生成的游离cGAMP会与cGAMP示踪剂竞争,导致发光减弱。
我们已将检测灵敏度优化至低于10 nM cGAMP与不足1 ng cGAS,适用于调控cGAS活性化合物的测试。通过改进细胞裂解条件,提升了多种cGAS激活剂细胞内生成cGAMP的回收率,并将其浓度与细胞因子释放关联。该检测法有望用于监测ALS与阿尔茨海默病患者血清和脑脊液中的cGAMP。该方法呈均相特性,LOPAC筛选假阳性率极低或无,符合HTS规格,一小时内即可完成。因此,该检测为STING通路调节剂研究提供重要工具,助力创新疗法开发。
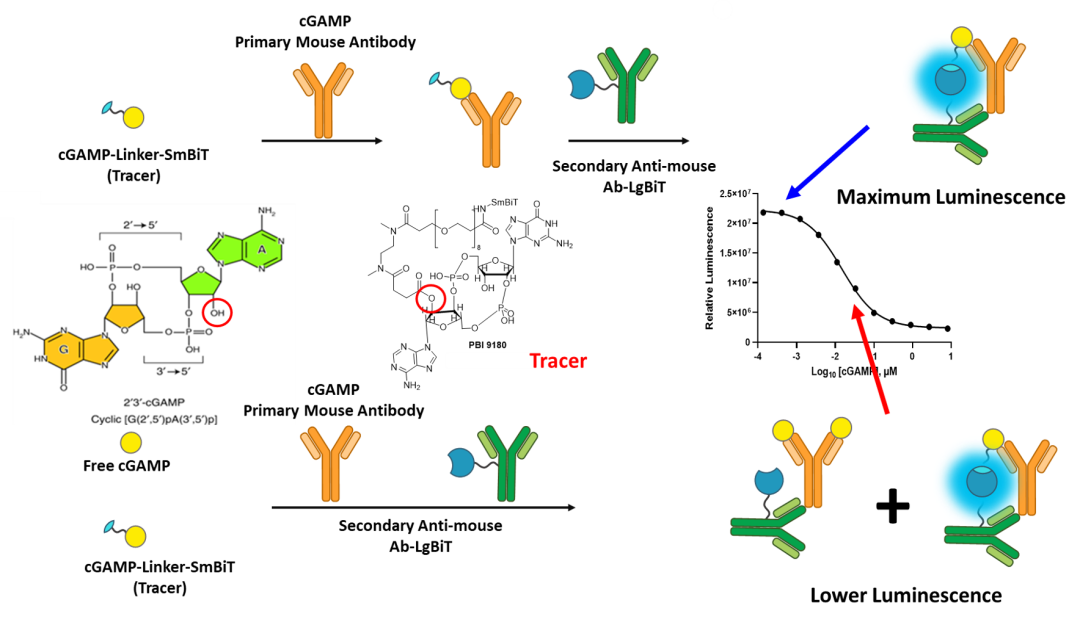
监测cGAMP浓度的cGAMP发光检测法示意图
检测特异性和灵敏度
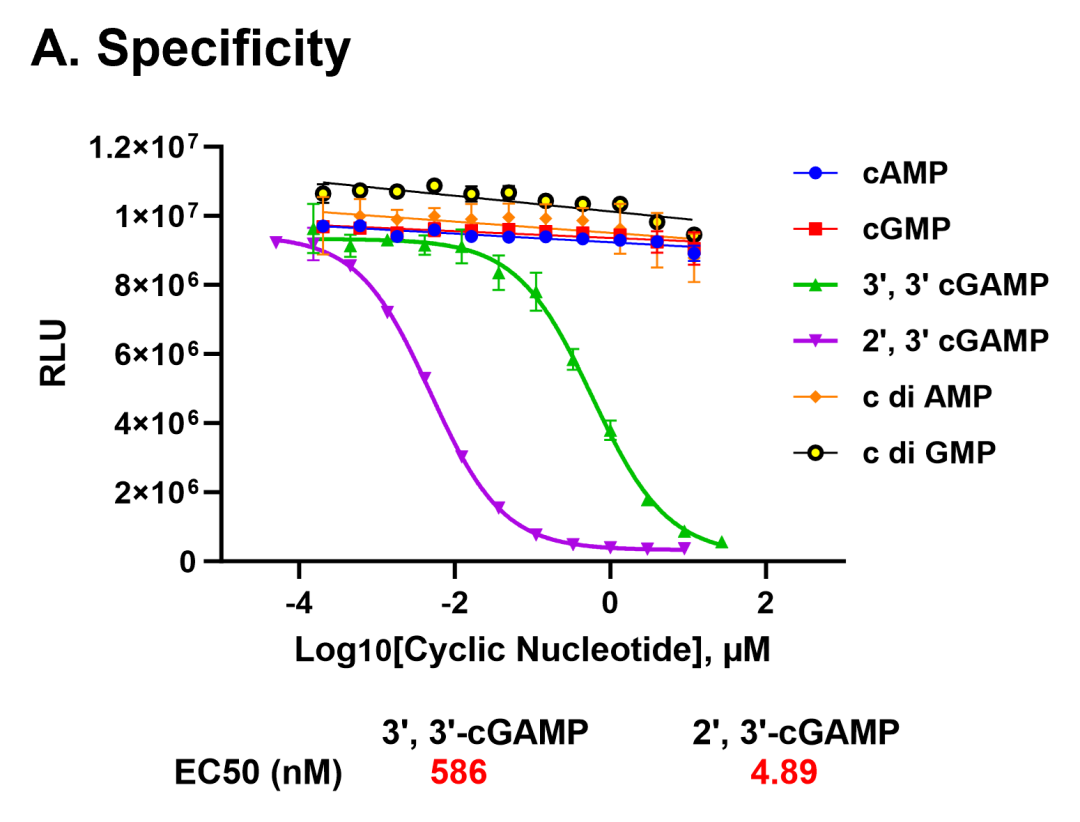
图A. 该测定方法对cGAMP具有高度选择性,在所有测试的环状核苷酸中,仅3',3'-cGAMP产生了微弱响应,但其效力较2',3'-cGAMP的检测灵敏度低100倍(EC50分别为586 nM与4.89 nM)。
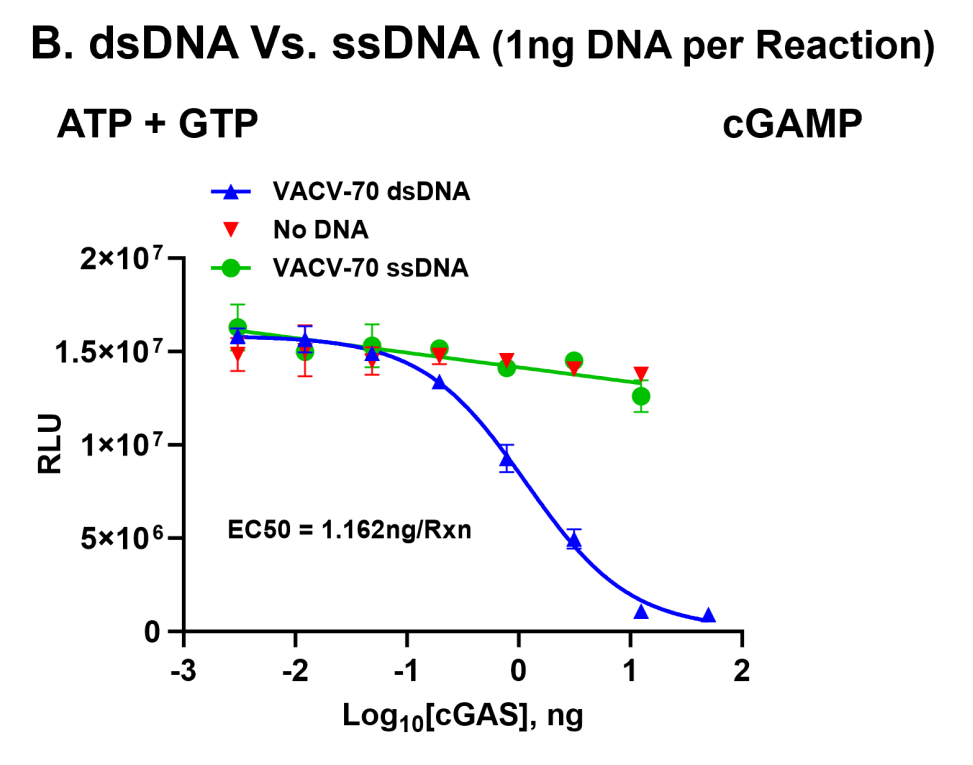
图B.进一步证实cGAS的激活需要双链DNA的参与——在添加单链DNA或无DNA的对照实验中均未观察到响应,这证明双链DNA是该酶激活的必要条件。
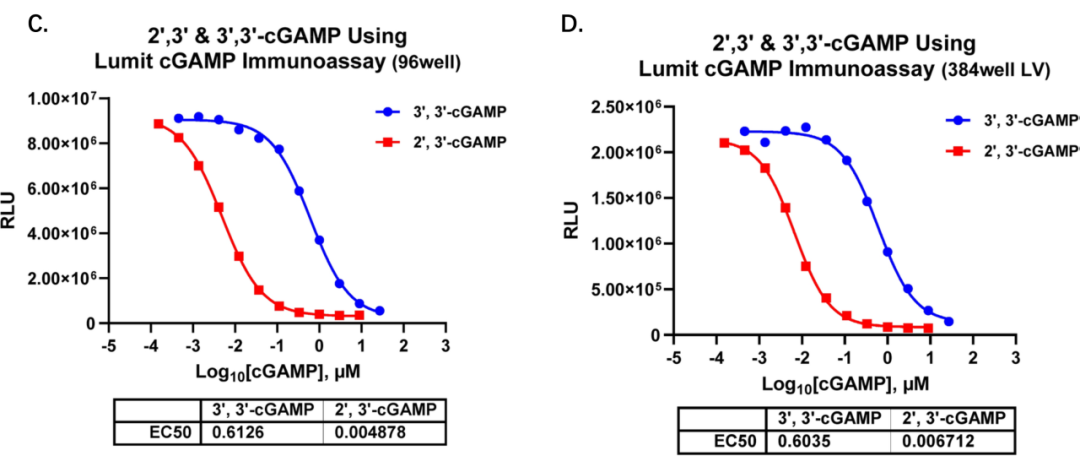
图C和D.在使用96孔和384孔低体积培养板时,该方法对2',3'-cGAMP的选择性依然显著优于3',3'-cGAMP,前者的EC50值比后者低100倍。
生化cGAS与ENPP1活性及抑制剂研究
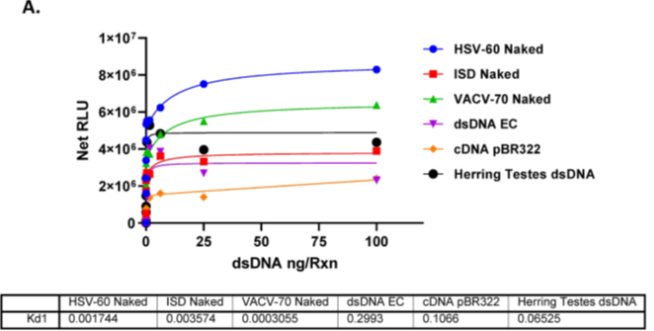
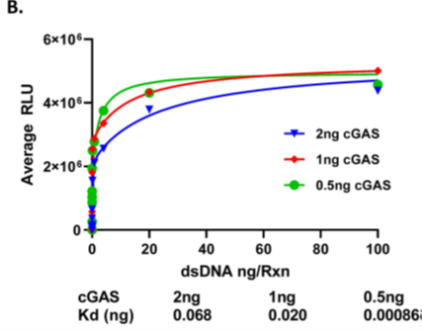
不同来源dsDNA对cGAS酶活性刺激作用的测试。我们评估了多种来源双链DNA在cGAS酶反应中的刺激效果,发现所有测试的双链DNA均能激活cGAS酶活性。其解离常数在7.5 fg/ml至7.5 ng/ml之间分布,最大酶活性响应对应的双链DNA浓度区间为156 ng/ml至625 ng/ml(具体数值因DNA来源而异)。HSV-60 dsDNA对cGAS的刺激强度随酶浓度变化而改变:当cGAS浓度为2 ng/ml时Kd为1.7 ng/ml,1 ng/ml时Kd为0.5 ng/ml,0.5 ng/ml时Kd为0.0215 ng/ml(图A,B)。
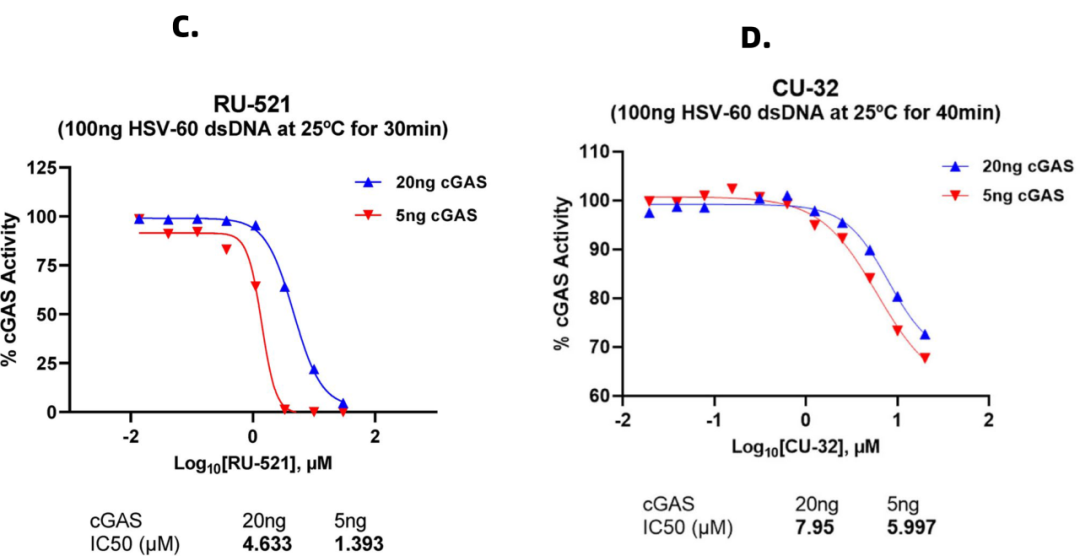
在生化反应中使用Lumit® cGAMP 技术评估cGAS抑制剂的效果。为验证本检测方法在抑制剂筛选中的应用价值,我们选用两种已知cGAS抑制剂(RU-521与CU-32)进行测试。实验采用两个cGAS浓度梯度(5 ng与20 ng),结果显示:随着酶浓度升高,两种抑制剂的IC50值均相应增加。数据表明RU-521的抑制效果显著优于CU-32——10 μM浓度的RU-521即可实现cGAS的强效抑制,而70 μM的CU-32仅使酶活性降低30%。本研究证实该检测方法适用于cGAS活性调节剂的高通量筛选,为开发具有临床潜力的抑制剂提供了可靠平台(图C,D)。
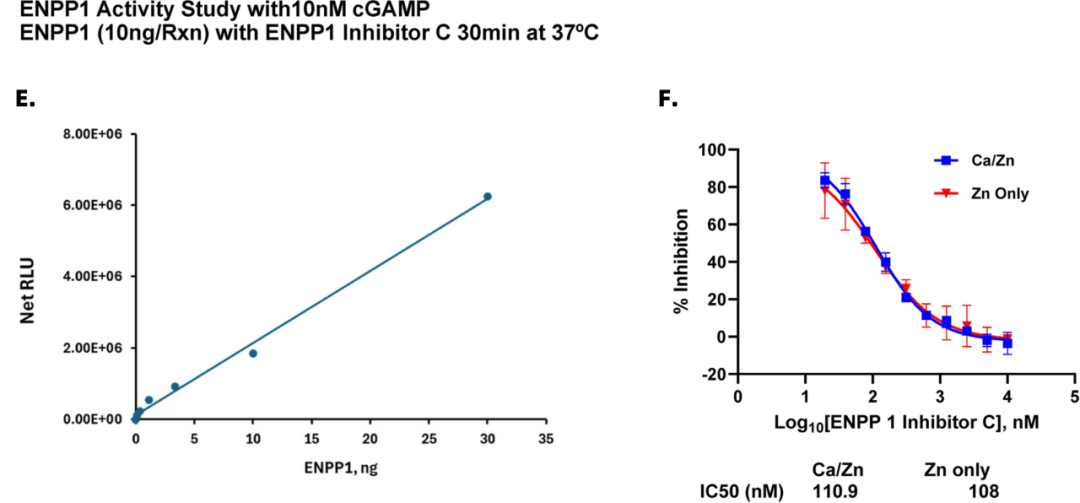
图E. 我们在此证明,Lumit® cGAMP 免疫检测法是筛选ENPP1抑制剂的理想方案。如图所示,在使用低至10 nM cGAMP作为底物的条件下,该检测方法对高达30 ng的ENPP1浓度梯度均呈现线性响应。
图F.在我们使用ENPP1抑制剂C进行的抑制研究中,IC50值分别为108 nM(仅含锌缓冲液)和110.9 nM(含钙/锌缓冲液)。无论是否存在钙离子,IC50值均基本一致,这表明CaCl₂对抑制剂效能影响甚微。
监测不同细胞系中多种dsDNA诱导的cGAMP水平
THP-1, THP-1 Dual, and THP-1 Dual KO cGAS using Reporter Assay
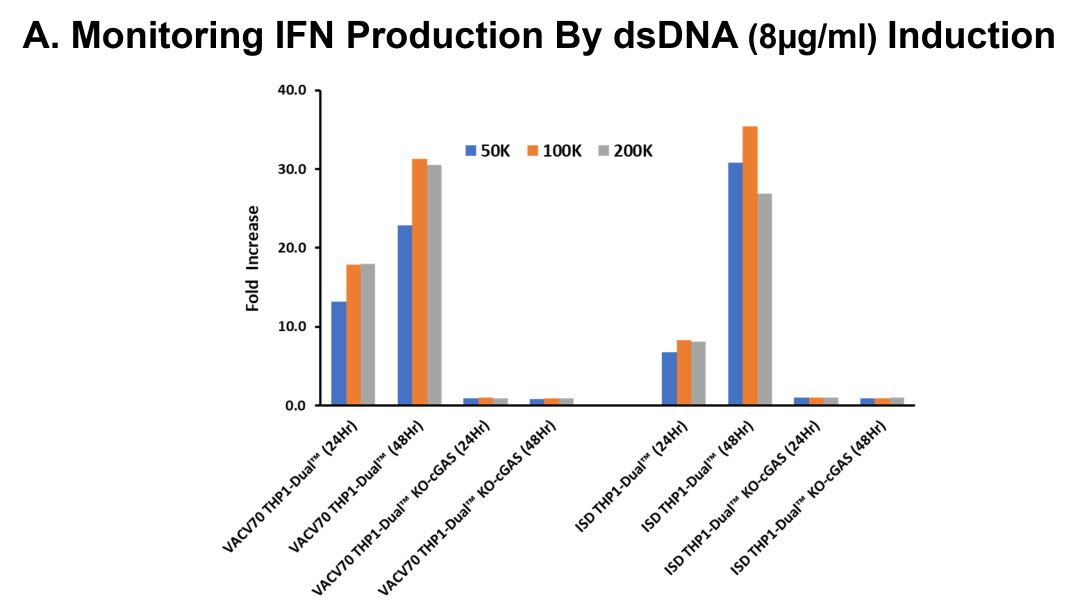
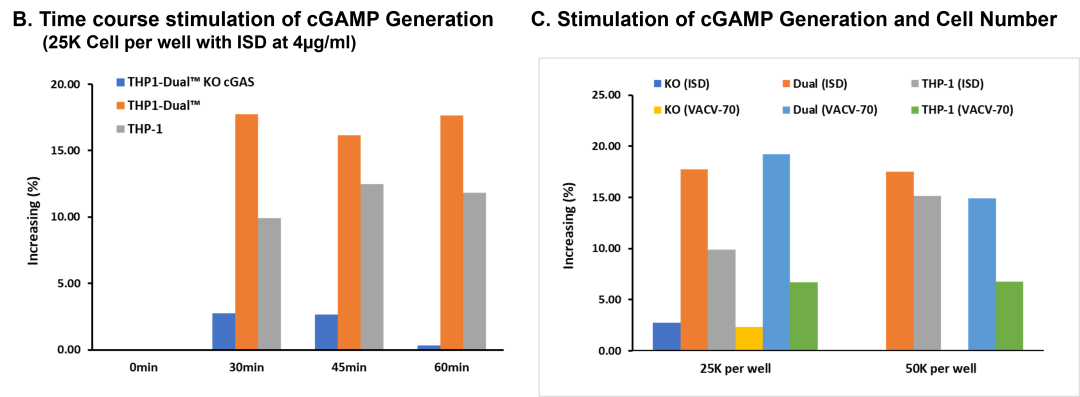
我们进一步验证了该检测方法的双重应用价值:既可定量cGAMP产量,又能评估cGAMP通过STING通路激活干扰素反应元件对报告基因活性的影响。为此,我们采用THP-1、THP1 Dual™及THP1-Dual™ KO-cGAS细胞系,在双链DNA刺激下监测细胞干扰素应答。THP1-Dual™细胞系通过稳定整合两种诱导型报告基因构建体,可同步监测NF-κB通路(通过SEAP活性)与IRF通路(通过Lucia萤光素酶活性)。
实验显示:用8 μg/ml VACV-70和ISD dsDNA处理48小时后,10万/孔细胞分别产生31倍和35倍以上的应答增强,而cGAS基因敲除细胞(THP1-Dual™ KO-cGAS)始终无应答,证实cGAS是该通路激活的必要条件。使用VACV-70与ISD dsDNA处理24小时即观察到干扰素应答增强,且当细胞数增至10万/孔时干扰素产量达到峰值。通过测试不同细胞数量与dsDNA孵育时间,我们发现在各细胞数量组中干扰素水平均呈现数倍提升(图B和C),但KO-cGAS细胞在VACV-70或ISD双链DNA刺激下始终未诱发干扰素应答。
Lumit® cGAMP通过监测cGAMP在生化体系及细胞内的浓度变化来评估STING信号通路的激活状态。上述的数据展示还表明,该检测技术能够定量分析合成cGAMP的cGAS酶与降解cGAMP的ENPP1酶的活性,并在其他环核苷酸及CDN分子共存条件下实现cGAMP的特异性检测。此外,应用该技术可评估cGAS抑制剂对cGAMP合成的抑制作用,最后也通过实验证实了该检测体系可灵敏检测dsDNA诱导的细胞内cGAS水平上调。
相关资源下载